이에 반해 존슨앤존스가 우리나라에서 운영 중인 보상 프로그램에서는 재수술비를 포함한 의료비·입원으로 인한 일실 임금·위자료 등의 명목으로 소액의 보상금만 지급하고 있다. 한국 법원도 비슷한 수준의 손해배상금 지급 판결을 할 것으로 예상되기 때문에 피해자들이 부득이하게 미국 법원에 소송을 제기한 것이다. (☞관련 기사 : 몸 속에 시한폭탄…인체 이식 의료기기의 불편한 진실)
지난 9월 30일 KBS 1TV <똑똑한 소비자 리포트>에서는 미국 법원에서 존슨앤존슨의 자회사인 드퓨이를 상대로 소송을 진행하고 있는 리콜 제품으로 수술 받은 피해자들의 목소리를 담은 '몸속의 시한폭탄, 인공 고관절 리콜' 편이 방영되었다.

존슨앤존스 자발적 리콜하니 식약처 공표 안 해
미국에서 소송 중인 제품은 2010년 8월 24일 전 세계적으로 자발적 리콜이 시행된 존슨앤존슨의 자회사인 드퓨이의 ASR 인공 고관절이다. 고관절이란 우리 몸의 상체와 하체를 연결하는 엉덩이 관절을 말한다. 여기에 문제가 생기면 걸을 수 없고, 극심한 고통으로 이중고를 겪는다. 치료 방법은 인공 고관절을 인체에 삽입하는 수술을 받는 것이다.
리콜된 이유는 존슨앤존슨의 인공 고관절 제품으로 수술받은 환자들에게서 수술 부위 조직이 괴사하거나 뼈가 녹는 부작용이 발생했고, 이로 인한 재수술률이 예상치 8∼9% 보다 12∼13%로 높게 나왔기 때문이다.
우리나라에서도 당시 8월부터 10월까지 이 제품에 대한 자발적 리콜이 진행되었다. 당시 허가 수입된 1338개 해당 제품 중 379개가 회수되었고, 909개는 이미 28개 의료기관에서 환자들에게 시술된 상태였다.
2010년 식품의약품안전처는 해당 제품에 대한 리콜 공표 명령을 하지 않았다. 존슨앤존슨이 보건 당국으로부터 적발되어 강제 리콜을 당한 것이 아니라 자발적 리콜을 실시했고, 실제 절차에 따라 해당 의료기관들에게 해당 제품을 사용해 수술한 환자들에게 연락할 것을 요청하면서 리콜된 인공 고관절 제품에 대한 정보와 보상 프로그램 관련 안내문을 해당 의료기관에 제공했다는 보고를 받았다는 이유에서다.
식약처의 공표 명령이 없었기 때문에 당연히 언론·방송을 통한 존슨앤존슨의 인공 고관절 제품 리콜 사실은 보도되지 않았고, 리콜된 제품으로 수술 받은 약 320여 명의 환자 상당수도 이러한 사실을 모르고 있었다.
이후 2013년 9월 28일 KBS <추적60분>에서 '환자만 몰랐다. 인공 고관절 리콜 사건의 진실' 편이 방영되어 사회적 이슈가 되고 나서야 해당 환자들이 존슨앤존슨의 인공고관절 제품이 리콜된 사실과 등록을 조건으로 하는 보상 프로그램이 운영 중인 사실을 알게 되었다.
인체 삽입 의료기기 리콜 시 병원에서 환자에게 고지 의무화
2010년 8월 24일부터 진행된 '존슨앤존슨'의 인공 고관절 제품 리콜 과정에서의 식약처의 안일한 대처와 사후 모니터링 부재 문제가 2013년 국정감사에서 중요 이슈로 부각되었고, 인체 삽입 의료기기로 수술 받은 환자들의 알권리와 안전을 위해 신속한 제도 개선이 요구되었다. 이에 따라 국회는 의료기기법 개정을 통해 인체 삽입 의료기기 리콜이 있는 경우 의료기관으로 하여금 의무적으로 해당 환자들에게 고지하도록 하였다.
즉, 인체에 중대한 부작용을 일으키거나 사망에 이르게 할 우려가 있는 의료기기의 경우 식약처장이 해당 의료기기를 사용한 의료기관 개설자에게 이 사실을 알려야 하고, 통보를 받은 의료기관 개설자는 해당 의료기기를 사용하여 치료를 받은 환자에게 방문, 우편, 전화, 전자우편 또는 팩스 등의 방법으로 알려야 한다. 이 경우 의료기관 개설자는 환자에게 통보한 사실을 증명할 수 있는 자료를 식약처장에게 제출해야 하며, 이를 위반할 경우 500만 원 이하의 벌금에 처할 수 있도록 하였다(의료기기법 제31조 제4항·제5항 및 제54조 제1항 신설).
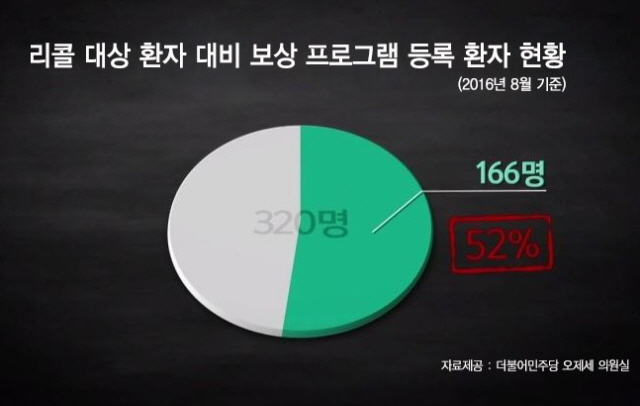
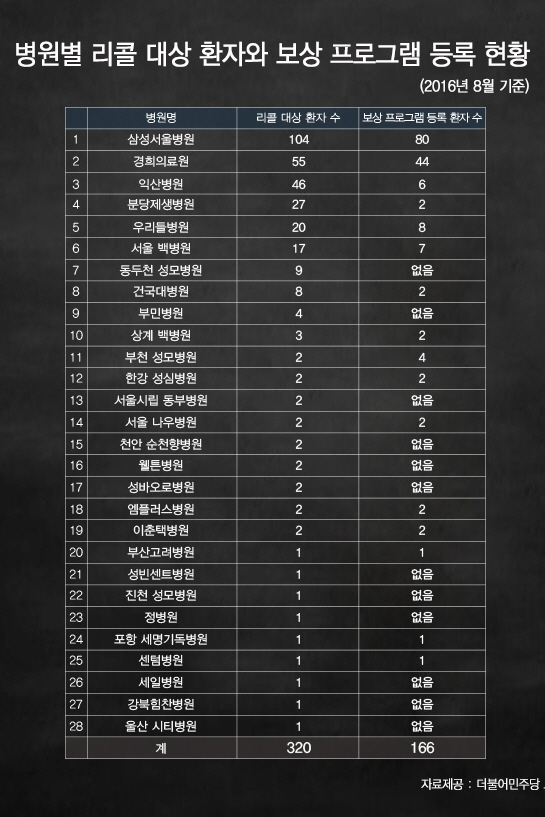
해당 환자 320명 중에서 166명이 리콜 사실과 보상 프로그램 고지 못 받아
더불어민주당 오제세 의원실에 따르면 존슨앤존슨의 인공 고관절 제품 리콜 사건이 발생한 2010년 8월 24일 이후부터 6년이 경과한 현재까지 약 320여 명으로 추정되는 리콜 대상 존슨앤존슨 인공 고관절 제품 수술 환자 중에서 공식 보상 프로그램에 등록한 환자는 절반 수준인 166명에 불과하다. 이는 나머지 절반의 환자들은 의료기관으로부터 리콜 사실과 보상 프로그램 관련 내용을 고지받지 못했다는 것을 의미한다. 더 큰 문제는 이 공식 보상 프로그램이 내년 2017년 8월 24일자로 종료된다는 점이다.
리콜 제품으로 수술 받은 환자들의 재수술률 대폭 높아져
존슨앤존슨의 자회사인 드퓨이의 ASR 인공 고관절 제품으로 수술받은 환자들의 재수술률 12~13%도 축소되었다는 의혹이 제기되었다. 실제 재수술률 관련해 2012년 호주정형학회 연례 보고서에서 전치환술(인공 고관절 삽입 수술)의 경우 7년 내 재수술률이 44%, 표면 치환술(손상된 부분만 긁어낸 후 인공 고관절 삽입 수술)은 7년 내 재수술률이 23.4%에 달한다고 밝히는 등 논란이 계속되고 있다. 또한 리콜 대상 존슨앤존슨 인공 고관절 제품으로 수술 받은 환자들의 혈액에 각종 질환을 유발하는 것으로 알려진 코발트와 크롬 성분이 검출되어 장기간의 추적 관찰이 필요하다.
이처럼 리콜 대상 존슨앤존슨 인공 고관절 제품으로 수술 받은 환자들의 재수술률이 기간이 경과함에 따라 높아지고 있고, 혈액으로 흘러 들어가 각종 질환을 유발할 수 있는 코발트와 크롬 성분의 장기 추적 관찰이 필요한 상황에서 2017년 8월 24일 공식 보상 프로그램을 종료하는 것은 비상식적이고 비윤리적인 조치다.
존슨앤존슨은 리콜된 인공 고관절 제품으로 수술 받은 환자 대상의 공식 보상 프로그램 운영 기간을 연장하고, 리콜 제품으로 수술한 28개 의료기관은 해당 환자들에게 신속하게 리콜 사실과 보상 프로그램 등록을 안내해야 한다. 아울러 식약처 또한 해당 의료기관을 대상으로 고지 의무 이행 여부를 철저히 관리 감독해야 한다.




전체댓글 0