정부가 지난 12일 무역투자진흥회의에서 발표한 '제6차 투자활성화 대책'에는 줄기세포 치료제와 유전자 치료제 임상시험 기준을 완화하는 내용이 들어가 있다.
정부는 상업용 1상 임상시험을 면제할 수 있는 연구자 임상 인정 범위를 현행 '자가 줄기세포 치료제'에서 '모든 줄기세포 치료제'로 확대키로 했다(식약처 고시 개정). 또 지금까지는 '생명을 위협하는 질병'이면서 '다른 치료법이 없는' 불치병인 경우에만 허용하던 유전자 치료제 임상시험을 둘 중 하나만 충족해도 되도록 터주기로 했다(생명윤리법 개정).
정부가 '임상시험 규제 완화' 카드를 꺼내든 까닭은 바이오산업을 '차세대 먹을거리 산업'으로 보기 때문이다. 정부는 이번 규제 완화의 근거로 "주요국 간 경쟁이 치열한 신약과 신의료 기술 분야에서 세계 시장을 선점해야 한다"는 점을 들고 있다.
줄기세포 치료제에 대한 상업용 1상 임상시험을 면제하면, 정부는 6개월~1년 정도 국내 시판 기간이 단축될 것으로 내다보고 있다.
정부의 진단처럼 의약품 허가 기준이 너무 강해서 한국의 바이오산업이 세계 시장을 선점하지 못하는 것일까? 전문가들은 철저하지 못한 안전성 검증 기준은 바이오 치료제가 세계 시장에 진출하는 데 오히려 독이 될 수 있다고 지적한다.
한국은 이미 신약 허가 기준이 선진국보다 허술하다. 식품의약품안전처에 따르면, 올해 7월 기준으로 전 세계에서 허가된 줄기세포 치료제 총 5개 중 4개가 한국 제품이다.
식약처(당시 식약청)는 지난 2011년 심근경색 환자에게 쓰이는 자가 줄기세포 치료제인 '하티셀그램 AMI'를 세계 최초로 국내에서 시판 허가했다. 이듬해인 2012년에는 무릎 연골 치료제인 카티스템을 허가했다. 이 역시 '동종 제대혈 유래 줄기세포' 치료제 가운데는 세계 최초 사례다.
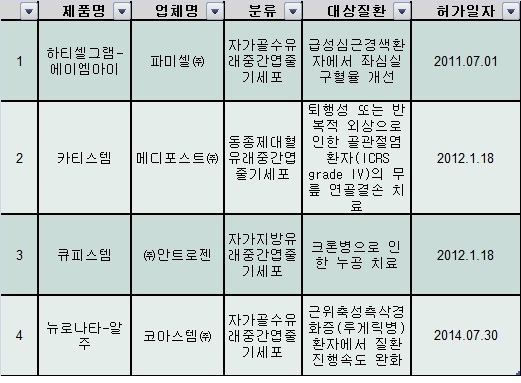
최근인 지난 7월 30일에는 루게릭병 치료제인 3년간 2상 임상시험을 거친 '뉴로나타-알주'를 허가했다. 일반적으로 의약품이 허가되려면 임상시험 3차례(3상)를 거쳐 안전성과 효과성을 입증받아야 하는데, 식약처는 해당 치료제가 희귀의약품이라는 예외 규정을 들어 2상 임상시험만 끝난 이 치료제를 신속하게 허가했다.
한국 제품 4개를 제외한 나머지 1개 치료제는 미국 기업이 개발했다. 미국의 바이오기업인 오사이리스 테라퓨릭스가 이식편대숙주병 치료제로 개발한 '프로키말(Prochymal)'이 2012년 캐나다에서 시판 허가를 받았다.
주목할 것은 이 기업이 정작 자국인 미국의 식품의약국(FDA)의 판매 승인은 받지 못했다는 점이다. 뒤집어 말하면, 미국 FDA의 승인을 받은 줄기세포 치료제는 아직 없다.
최규진 보건의료단체연합 기획국장은 "미국에서 줄기세포 치료제 임상시험이 세계에서 가장 많이 진행되고 있음에도, 아직까지 한 건도 허가하지 않은 것은 그만큼 줄기세포 치료제의 안전성에 대한 검증이 요구되고 있기 때문"이라고 말했다.
세계 최초 중국 유전자 치료제, 세계 시장 외면…왜?
실제로 줄기세포 치료제와 유전자 치료 기술에 대한 세계의 시각은 냉정하다. 세계 시장이 원하는 것은 규제 완화가 아니라 '안전하다는 임상적 증거'다.
줄기세포 치료제보다 연구가 덜 됐다는 유전자 치료제의 경우를 보자. 2004년 1월 중국의 식품약품감독관리국(SFDA)는 중국의 바이오업체인 시비오노 젠테크(Sibiono Genthch)가 개발한 두경부 암 치료제인 젠다이신(Gendicine)의 자국 내 시판을 허가했다. 세계 최초이자 현재 전 세계에서 유일하게 시판 허가된 유전자 치료제다.
그러나 10년이 지난 지금, 젠다이신은 연구자들의 뇌리에서 잊히고 있다. 중국을 빼고 다른 국가에서 허가받지 못한 탓이다. 세계적으로 권위적인 과학 전문지인 <네이처>는 2004년 '중국이 첫 번째 유전자 치료를 허가하다'라는 기사를 통해 "젠다이신 임상시험 참여자 수가 120명에 불과했"기 때문이고 꼬집었다. 반면에 미국에서 똑같은 치료법으로 수백 명 규모의 임상시험이 이뤄졌지만, 미국은 아직 해당 치료제를 승인하지 않았다는 것이다.
<네이처>는 "중국의 규제는 다른 국가보다 훨씬 결여돼 있다"며 "(반면에) 미국에서 유전자 치료제를 병원에 들이는 과정은 보수적이다. 안전에 대한 우려가 엄격하지만, 이는 타당하다"고 평가했다.
중국과는 달리, 일본에서 진행되는 유전자 치료제 임상시험은 다른 통상적인 임상시험보다 오래 걸린다는 점도 대조적이다. 일본 후생노동성은 유전자 치료에 대해 "동물 실험, 환자들을 대상으로 한 임상시험, 해당 약의 질을 담보하는" '확실한 허가 신청'을 요구하기 때문이다. 게다가 일본의 건강한 사람들은 '실험적인 치료'가 내포한 높은 위험성 때문에 1상 임상시험에 참여하려고 하지 않는 탓이다.

임상시험 피험자 120명으로 비판 받은 중국…한국은? 100명 미만
한국 줄기세포 치료제에 대한 연구진들의 평가도 야박하기는 마찬가지다.
<네이처>의 2011년 7월 자 '한국, 다시 줄기세포 조명을 받다'라는 제목의 기사를 보자. <네이처>는 황우석 사태 이후 고전을 면치 못하던 한국이 줄기세포 치료제인 '하티셀그램-에이엠아이'를 시판 허가했다는 사실을 전하면서, 그 과정이 "실망스럽다"고 적었다. 독립적인 전문가 검토가 부족하고, 효과성이 충분히 검증되지 않았다는 것이다.
중국이 120명 임상시험 참여자로 비판을 받았지만, 한국의 임상시험 참가자들은 그보다 더 적다는 점도 논란거리다. 세계 최초 한국에서 시판 허가된 하티셀그램-에이엠아이에 참여한 임상시험 환자는 급성심근경색 환자군 40명과 대조군 환자 40명 등 총 80명에 불과하다.
심지어 해당 임상시험을 주도한 교수가 언론과의 인터뷰에서 "구체적인 치료 효과를 입증하려면 적어도 1000명(대조군 포함 2000명)은 필요하다"며 "시판되기에는 아직 데이터가 크게 부족하다"고 말할 정도였다. (☞ 관련 기사 : '꿈의 신기술'이라는 줄기세포 성형외과 직접 가보니…)
나머지 줄기세포 치료제 3개도 모두 임상시험 참가자 수가 100명을 넘지 않는다. 세계 최초의 '동종 유래 줄기세포' 치료제이인 카티스템의 임상시험 피험자 수는 대조군을 모두 더해도 89명이다. 세계 3번째 줄기세포 치료제인 큐피스템의 피험자 수는 대조군을 더해도 33명이며, 가장 최근 허가된 '뉴로나타-알주'의 피험자 수도 64명에 불과하다. 이들 제품이 선진국에서 아직 '시판 허가'되지 않았음은 물론이다.
<네이처>는 하티셀그램-에이엠아이를 투여받은 금성심근경색환자 가운데 6%의 좌심박출률이 6% 증가했다는 보도를 전하면서도, "안전성이 검증되지 않은 효과성은 대부분의 치료제의 걸림돌이 되고 있다"고 지적했다.
* 참고 자료Sue Pearson 등, <China approves first gene therapy>, nature biotechnology, 2004-3, 4David Cyranoski, <South Korea 'back in the stem cell spotlight'>, nature, 2012-07-09
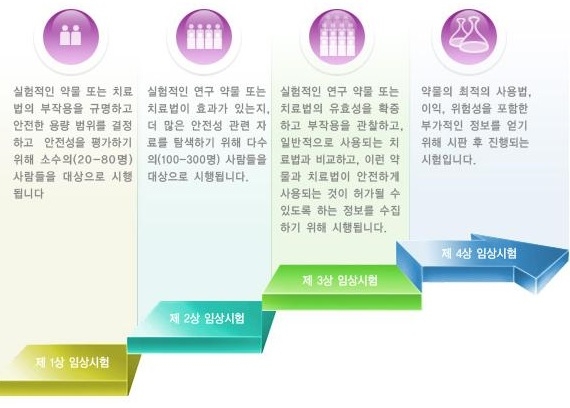
* 용어 설명상업용 1상 임상시험 : 의약품 시판이 허가되기 전에 안전성을 검토하는 가장 첫 번째 임상시험 단계. 건강한 사람들을 수십 명을 대상으로 약의 효능이나 예기치 못한 부작용을 검토한다.2상 임상시험부터는 대개 100명 이상의 실제 환자들을 대상으로 진행된다. 3상 임상시험에서는 대개 수백~1000명 이상을 대상으로 최종 안전성과 효과성을 검토한다. 3상이 끝난 뒤 식약처는 의약품을 최종 승인하고, 해당 의약품이 시판된 이후에도 추가 위험성을 장기간 관찰하는 4상 임상시험이 계속된다.연구자 임상시험 : 임상 시험자(대개 의대 교수)가 외부의 의뢰 없이 안전성, 유효성이 검증되지 않은 의약품, 또는 허가(신고)되어 시판 중인 의약품으로 허가(신고)되지 아니한 새로운 효능·효과, 새로운 용법 용량에 대해 독자적으로 수행하는 임상시험.
세포 치료제만 특례…합성의약품과 형평성은?정부가 추진하는 바이오 의약품 임상시험 기준 완화 조치는 기존 화학 합성의약품과 형평성 측면에서도 맞지 않는다. 기존 합성의약품은 연구자가 임상시험을 하더라도 상업 임상시험을 할 때 1상 임상시험이 면제되지 않는 탓이다.전문가들은 이번 규제 완화가 거꾸로 된 조치라고 우려한다. 최규진 보건의료단체연합 기획국장은 "자가 유래 줄기세포도 위험하지만, 동종 유래 줄기세포의 경우 배양·증식 등 위험성을 가중시키는 외부 조작이 가해지는 경우가 많다"며 "명확한 기준 제시 없이 무분별하게 1상 임상시험을 면제해준다는 것은 전 세계 어느 나라에서도 찾아볼 수 없는 위험한 조치"라고 비판했다.실제로 보건복지부는 2012년 12월 보도자료를 내고, 자가 유래 줄기세포라고 하더라도 위험할 수 있다고 경고한 바 있다. 구체적으로는 "세포를 체외에서 조작·배양하는 과정에서 유전자 변형 발생 가능성, 대량 배양한 세포의 일시 투입에 따른 부작용 가능성, 자연 상태에서 인체 내 존재하지 않는 부위에 투여지 체내에서의 작용에 대한 예측 불가능성, 종양(암) 유발 가능성" 등을 예시했다.안전성 우려에 대해 식약처는 자체적으로 안전성을 검토한 뒤 임상시험을 면제하기 때문에 문제없다는 입장이다. 식약처 관계자는 "연구자 임상시험도 상업화 임상시험에 준하는 기준으로 검토한다"며 "식약처가 안전하다고 판단한 때에만 연구자 임상시험 결과를 상업화 1상 임상시험 자료로 갈음한다는 의미"라고 설명했다.다른 합성의약품 임상시험 기준의 형평성 문제에 대해서도 식약처 관계자는 "세포 치료제 분야는 (세계적인) 경쟁이 치열하고, 국가적으로 개발을 지원해야 하므로 특례적으로 조치하고 있다"며 "합성의약품도 (상업 1상 임상시험을 면제할) 필요성이 있다는 요구가 들어온다면, 그런 제도의 도입을 고려해볼 수는 있을 것"이라고 부연했다.



전체댓글 0